یکی از عوامل کلیدی در استفاده غیر ضروری از آنتی بیوتیک ها و افزایش بار مقاومت آنتی بیوتیکی در جهان، فقدان تست های تشخیصی سریع و دقیق است . بنابراین، نیاز مداوم به کشف نشانگرهای حساس و اختصاصی جدید عفونت باکتریایی وجود دارد. یکی از کاندیداها، تعیین فلوسایتومتری مارکرها و گیرنده های میزبان بر روی سطح لکوسیت های خون است. فرضیه پشت این ایده این است که لکوسیت های خون محیطی به عنوان حسگرهای زیستی عمل می کنند که به تغییرات ناشی از پاتوژن (به عنوان مثال یک باکتری یا ویروس) در پروفایل سیتوکاین سیستمیک پاسخ می دهند. تا به حال، افزایش بیان گیرنده (FcgRI/CD64) روی نوتروفیلها پرکاربردترین (و تنها) نشانگر فلوسایتومتری عفونت (هم باکتریایی و هم ویروسی) و همچنین شدت عفونت بوده است. علاوه بر اینکه نشانگر حساسی برای تشخیص عفونت باکتریایی است، افزایش بیان CD64 روی نوتروفیلها میتواند در عفونتهای ویروسی (به ویژه در عفونتهای ویروسی DNA دار رخ دهد و بنابراین نمیتوان به طور واضح برای تمایز بین بیماریهای باکتریایی و ویروسی استفاده کرد .
در مقایسه با نوتروفیل CD64، گیرنده مکمل نوتروفیل 1 (CR1/CD35) به نظر می رسد نشانگر عفونت باکتریایی اختصاصی تری باشد. در سال 2006، کشف شد که میانگین سطح بیان CD35 بر روی نوتروفیلها در عفونتهای باکتریایی بیش از سه برابر بیشتر از عفونتهای ویروسی و کنترلهای سالم است، که در تشخیص عفونتهای باکتریایی و ویروسی، حساسیت و ویژگی 85 درصد را نشان میدهد. در همان مقاله، تمایز مبتنی بر CD35 نوتروفیل بین عفونتهای باکتریایی و ویروسی با ایجاد امتیاز عفونت بالینی (CIS)، با ترکیب چهار متغیر، تجزیه و تحلیل کمی فلوسایتومتریCD35 ، CD11b و CR3 بیشتر بهبود یافت. در مورد نوتروفیل ها و داده های آزمایشگاهی بالینی استاندارد، سطح سرمی CRP و سرعت رسوب گلبول های قرمز و نقطه CIS هنگام تمایز بین عفونت های باکتریایی و ویروسی 98٪ حساسیت و 97٪ ویژگی را نشان داد. از این مطالعه خاص، ما دریافتیم که هر نشانگر عفونت باکتریایی به تنهایی نمی تواند برای تمایز قابل اعتماد بین عفونت های باکتریایی و ویروسی استفاده شود و دقت تشخیصی را می توان با ترکیبی از چندین نشانگر عفونت باکتریایی بهبود بخشید. از سال 2006، سه روش دیگر (فلوسایتومتری) امتیاز/شاخص چند پارامتری را برای تمایز بین عفونتهای باکتریایی و ویروسی توسعه داده شد:
- امتیاز عفونت باکتریایی (BIS)، که اولین مارکر عفونت باکتریایی فلوسایتومتری خالص بود،
- شاخص عفونت باکتریایی BI
- شاخص عفونت باکتریایی دو رنگ (TC-BI).
بر اساس آنچه از کارهای قبلی خود در این زمینه آموخته ایم، می توانیم نتیجه بگیریم که سه اصل اساسی زیربنای مفهوم نشانگر عفونت باکتریایی فلوسایتومتری کارآمد وجود دارد:
1) چند پارامتری باشد.
2) سریع و کاربردی با حداقل مقدار جابجایی نمونه باشد
3) فقط به یک اندازه گیری از یک لوله آزمایش نیاز داشته باشد.
در نتیجه، یک مارکر عفونت باکتریایی جدید که تمام معیارهای فوق را برآورده می کند، اکنون ایجاد شده است. در این مطالعه روش فلوسیتومتری چند پارامتری واقعا قابل اجرا، شاخص عفونت باکتریایی چهار رنگ (FCBI) را ارائه میکنیم که بر اساس تشخیص تعداد نسبی گیرندههای CD35، CD64 و CD329 بر روی نوتروفیلها و لنفوسیتها است.
از بین گیرنده های التهابی مورد مطالعه، CD35 بر روی گرانولوسیت ها، مونوسیت ها، سلول های B، سلول های دندریتیک فولیکولی، گلبول های قرمز، سلول های NK و در سطوح پایین بر روی سلول های T بیان
می شود. این یک گیرنده فاگوسیتوز است که فرآیند فعال سازی مکمل اتولوگ در محل عفونت را نیز مختل
می کند.
CD64 روی مونوسیتها، ماکروفاژها، سلولهای دندریتیک در گردش و در سطوح پایین بر روی نوتروفیلها و لنفوسیتهای در حال استراحت بیان میشود. یکی از عملکردهای اصلی آن تعدیل سینتیک هر دو اندوسیتوز و فاگوسیتوز با واسطه گیرنده است.
لکتین 9 شبه Ig متصل به اسید سیالیک (Siglec9/CD329) عضوی از خانواده پروتئین های شناسایی اسید سیالیک است که به شدت بر روی نوتروفیل ها و مونوسیت ها بیان می شود و تنها به میزان ضعیفی روی لنفوسیت ها و سلول های NK بیان می شود CD329. در پاتوژنز سپسیس از طریق تعامل با گیرنده Toll like receptor 4 ، تنظیم پلاریزاسیون ماکروفاژها و مهار تحریک نوتروفیل ها درگیر است. همچنین گزارش شده است که از طریق اتصال به پروتئین چسبنده عروقی 1 (VAP-1/AOC3) در سلول های اندوتلیال عروقی، در مهاجرت لکوسیت ها از خون به محل های التهاب شرکت می کند.
مولکول های اصلی کمپلکس سازگاری بافتی I (MHCI) که پپتیدهای آنتی ژن درون زا (ویروسی) را متصل
می کنند و آن ها را به سلول های T سیتوتوکسیک CD8 مثبت ارائه می کنند، در سطح سلولی تمام سلول های هسته دار در بدن مهره داران یافت می شوند. نقش آنتی بادی ضد MHCI نشاندار شده با فلورسنت در روش ارائه شده، جداسازی جمعیت نوتروفیل و لنفوسیت فلورسنت از بقایای غیر فلورسنت است.
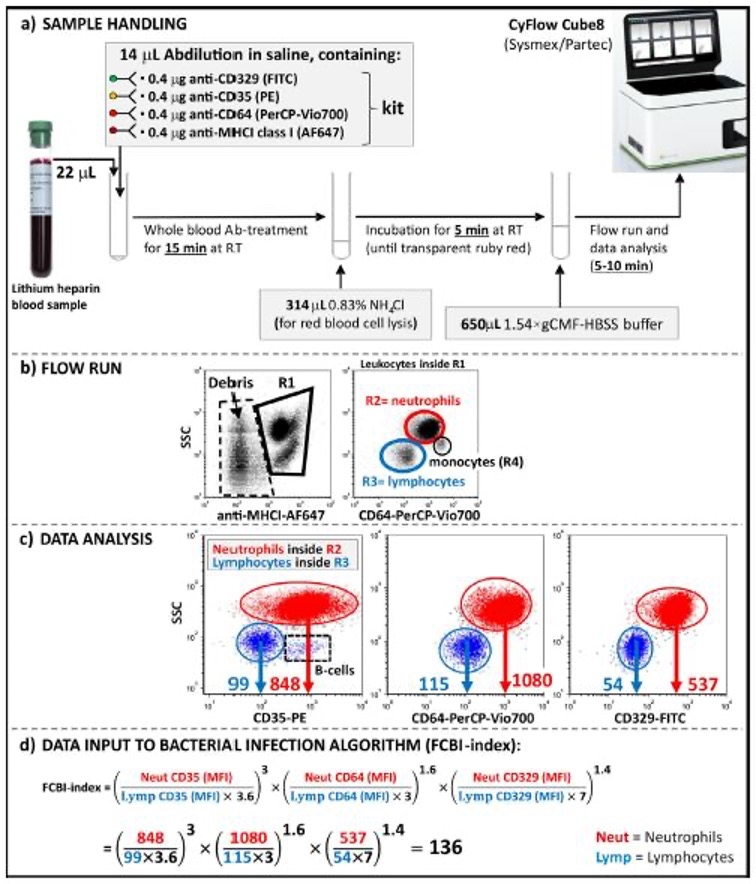
شکل1. یک نمودار شماتیک در مورد نحوه محاسبه مقدار شاخص FCBI در بیمار مبتلا به پنومونی استرپتوکوکی تایید شده میکروبیولوژیکی با استفاده از روش جدید FCBI-index.
بخش (a) انکوباسیون نمونه خون کامل با آنتیبادیهای خاص گیرنده، لیز گلبولهای قرمز و اجرای فلوسیتومتری یکی پس از دیگری در همان لوله آزمایش انجام شد.
(b) در طول اجرای فلوسایتومتری، جمعیت لکوسیت در دروازه R1 ابتدا از هیستوگرام دو متغیره پراکنده جانبی (SSC)/MHCI خارج شد، پس از آن دروازههای R2 (قرمز) و R3 (آبی) در اطراف جمعیتهای نوتروفیل و لنفوسیت قرار گرفتند. به ترتیب، در هیستوگرام دو متغیره SSC/CD64 حاوی لکوسیت ها در داخل دروازه R1 تعداد توقف 1000 مونوسیت در داخل دروازه مونوسیت R4 (سیاه) مورد استفاده قرار گرفت که منجر به جمع آوری 5000-20000 لکوسیت شد.
(c) به منظور تجزیه و تحلیل دادهها، سه هیستوگرام دو متغیره اضافی، یعنی SSC/CD35، SSC/CD64 و SSC/CD329 ساخته شد که میانگین شدت فلورسانس را نشان میدهد (MFI)، که با تعداد گیرندههای روی سطح سلول مرتبط است. جمعیت نوتروفیل (قرمز) و لنفوسیت (آبی). در هیستوگرام SSC/CD35، لنفوسیت های B بیان کننده CD35 در خارج از دروازه لنفوسیت باقی ماندند. (د) مقدار واقعی شاخص FCBI با جایگزینی دادههای MFI خاص گیرنده از جمعیتهای نوتروفیل و مونوسیت در الگوریتم عفونت باکتریایی محاسبه شد.
نتایج
در مطالعه حاضر مشخص شد که استفاده از شاخص FCBI می تواند در تشخیص و افتراق دقیق عفونت های ویروسی از باکتریایی کارآمد باشد. همچنین با این روش می توان از تجویز آنتی بیوتیک ها برای درمان عفونت های ویروسی جلوگیری کرد که کمک شایانی به جلوگیری از مقاومت های آنتی بیوتیکی در آینده خواهد شد. همچنین با استفاده از این روش تشخیصی می توان به عفونت های پنهان باکتریایی پی برد و درمان مناسب را برای بیمار در نظر گرفت. به عنوان مثال در این مطالعه، تمایز بین عفونتهای باکتریایی (193 مورد) و ویروسی (291 مورد) تایید شده میکروبیولوژیک، روش FCBI-index بهتر از روش های (CRP) و (PCT) بود. در 269 عفونت ویروسی دستگاه تنفسی تایید شده، 43٪ از بیماران دارای شاخص FCBI افزایش یافته بودند که نشان دهنده عفونت همزمان باکتریایی است.
Reference:
Nuutila J, Hohenthal U, Oksi J, Jalava-Karvinen P. Rapid detection of bacterial infection using a novel single-tube, four-colour flow cytometric method: Comparison with PCT and CRP. EBioMedicine. 2021 Dec 1;74