مقالات
ایمونوفنوتایپینگ لنفوسیتهای T
فلوسایتومتری چند رنگی (multicolor flow cytometry) در میان روشهایی که برای مطالعه سلولهای T استفاده میشود برجسته است زیرا امکان شناسایی زیرجمعیتهای بسیار پیچیده سلولهای T – از نظر عملکردی و از نظر فنوتایپی را ممکن میسازد. فنآوریهای تکمیلی مانند ELISA، ELISPOT و bead-based immunoassays نیز تحقیقات بیشتری را در ناحیه سلولهای T انجام داده و انعطافپذیری را برای برآوردن طیف وسیعی از نیازهای تجربی و روشهای متعدد برای تأیید نتایج ارائه میدهند.
برخی فناوریها میتوانند اطلاعات خاصی را در مورد یک نمونه نشان دهند یا ممکن است نیازهای عملی مانند ابزار دقیق موجود یا نوع نمونه را بهتر برآورده کنند. در برخی موارد، محققان میتوانند از اطلاعات ترکیبی از چندین تکنیک برای تأیید نتایج استفاده کنند. رویکردهای مختلف میتوانند تصویری دقیق از مکانیسمهای کمک کننده به رشد سلولهای T ارائه دهند.
ایمونوفنوتایپینگ (Immunophenotyping): ترکیب مارکرهای سطحی و درون سلولی
با استفاده از فلوسایتومتری چند رنگی – و ترکیب فنوتایپ سطحی با رنگ آمیزی درون سلولی سایتوکاینها، فاکتورهای رونویسی یا مولکولهای سیگنال دهنده – میتوانید زیر مجموعههای تک سلولی T را بر اساس علامت مارکر مشخصه آنها شناسایی کنید. سیستمهای معرف پیشرفته گوناگون، انتخاب گسترده مارکر و ابزارهای پشتیبانی فراوان، به محققان کمک میکنند تا فنوتایپینگ را ساده کرده و اطلاعات بهدستآمده از نمونههای جداگانه را به حداکثر برسانند.
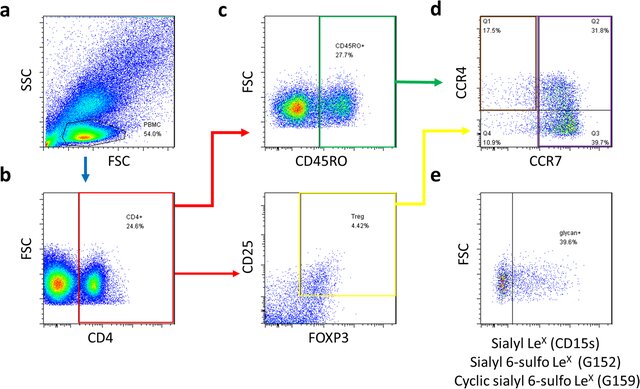
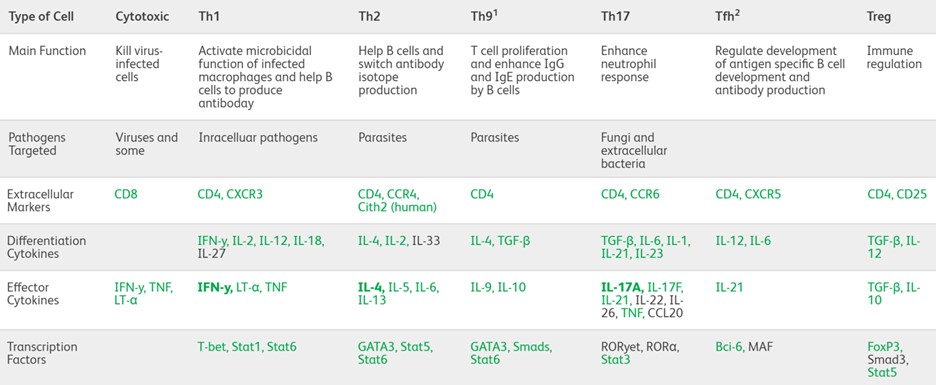
ایمونوفنوتایپینگ توسط فلوسایتومتری، یک ابزار تحقیقاتی ارزشمند، از بیان متفاوت مارکرهای سلولی برای جداسازی و مشخص کردن سلولهای T و زیرمجموعههای آنها استفاده میکند. سلولهای T و زیرمجموعههای آنها را میتوان با بیان متفاوت مارکرهای سطح سلولی از جمله CD3، CD4، CD8 و CD25 تعریف کرد. با استفاده از پانلهایی از آنتی بادیهای فلورسنت کونژوگه مستقیم به این مارکرهای خاص، تجزیه و تحلیل فلوسایتومتری چند رنگ به محققان اجازه میدهد تا سطوح چندین مارکر را به طور همزمان بر روی سلولهای جداگانه بررسی کنند. این امر میتواند اطلاعاتی در مورد اصل و نسب سلولی و وضعیت تمایز زیر مجموعههای سلولی در یک نمونه خاص را ارائه دهد. افزودن مارکرهایی مانند CCR7، CD62L یا CD69 به یک آنالیز، اطلاعات مهمی در مورد پتانسیل سلولها برای قرار گیری و محلی شدن در بدن و همچنین وضعیت فعالسازی زیرمجموعه سلولهای T مورد نظر را فراهم میکند. با تجزیه و تحلیل الگوهای بیان شده مارکرهای مختلف – از جمله نه تنها گیرندههای سطح سلولی، بلکه پروفایلهای ترشح سایتوکاین و مولکولهای سیگنالینگ درون سلولی – محققان فنوتایپهایی را تعریف کرده اند که زیر مجموعههای سلول T که از نظر عملکردی متمایز هستند را ارائه میدهند (مانند Th1، Th2، Th17، Treg، Th9).
جداسازی جمعیتهای سلولی انتخاب شده با مرتب سازی سلولی (cell sorting)
جمعیتهای سلولی تعریف شده را میتوان با استفاده از ترکیب خاصی از مارکرهای سطحی و مرتب کنندههای سلولی، مانند سیستمهای فلوسایتومتری FACSAria III، FACSMelody و FACSymphony S6 از مخلوطهای سلولی پیچیده جدا کرد. جمعیتهای سلولی خالص شده و زنده را میتوان بواسطه کشت گسترش و تمایز داد و از آنها نگهداری کرد. برای کاربردهای خاص، دانشمندان پروتکلهای دقیقی را برای سورتینگ سلولی ایجاد کرده اند، مانند روشی برای جداسازی سلولهای Treg انسانی با استفاده از سلولهای غنیشده با CD4 و سورتینگ بر روی فنوتایپ پایین CD4+CD25int-hiCD127 که کارایی و بازدهی بالاتری را ارائه میدهد.
تشخیص سایتوکاین داخل سلولی برای تجزیه و تحلیل پاسخهای زیر مجموعه سلول T
تشخیص سایتوکاینهای داخل سلولی با استفاده از فلوسایتومتری چند رنگی ابزاری قدرتمند برای به دست آوردن بینش در مورد طیف پاسخها در جمعیتهای مختلط سلولها است. با اندازهگیری همزمان چندین سایتوکاین و مارکرهای سطح سلولی در یک سنجش، این تکنیک بینشی را ارائه میدهد که کدام زیر مجموعه سلولی کدام سایتوکاینها را تولید میکند. به عنوان مثال، فلوسایتومتری چند رنگی را میتوان برای شناسایی سلولهای Th1، Th2 یا Th17 بر اساس امضای سایتوکاین مشخصه آنها استفاده کرد. تجزیه و تحلیل سلول به سلول به محققان اجازه میدهد تا پاسخهای زیر مجموعههای سلولی متمایز را بدون جداسازی فیزیکی آنها تجزیه و تحلیل کنند.
سیستمهای تشخیص سایتوکاین داخل سلولی
برای تشخیص پروتئین درون سلولی، سلولها باید ثابت و نفوذ پذیر شوند تا به آنتی بادی فلورسنت اجازه ورود داده شود و این آنتی بادی بتواند پروتئین مورد نظر را شناسایی کند. آنتی ژنهای مختلف حساسیتها و الزامات مختلفی را برای تثبیت و نفوذپذیری دارند که مستلزم بهینه سازی اضافی پروتکلها است. برای شناسایی سایتوکاینها که پروتئینهای ترشح شده هستند، به مهار کنندههای انتقال پروتئین برای به دام انداختن پروتئینها در داخل سلولها نیاز است. دو سیستم سنجش پرکاربرد برای تشخیص سایتوکاین درون سلولی ارائه میشود: معرفهای Cytofix/Cytoperm و FastImmune Cytokine System. هر دو سیستم سهولت و اطمینان استفاده از معرفها و پروتکلهای آزمایششده را به محققان ارائه میدهند و استاندارد بالای کیفیت و تکرارپذیری را که محصولات فلوسایتومتری برخی شرکتها به آن معروف هستند، در خود جای میدهند.
سیگنالینگ داخل سلولی
سلولهای T توسط مسیرهای پیچیده شامل چندین مولکول انتقال سیگنال، از جمله گیرندههای آنتی ژنها و سایتوکاینها، کینازها و فاکتورهای رونویسی، فعال و تنظیم میشوند. سیگنالهای مربوط به فسفوریلاسیون پروتئین در تمایز سلولهای CD4+ T ساده به سلولهای Th1، Th2، Th9، Th17، Tfh یا Treg نقش دارند.
نظارت بر سلول T تنظیمی
رنگ آمیزی FoxP3
FoxP3 (همچنین به عنوان Scurfin، IPEX و JM2 شناخته میشود) یک فاکتور سرکوب رونویسی از خانواده فاکتورهای رونویسی سر چنگال است. مشخص شده است که FoxP3 در تمام سلولهای CD4+Treg که فعالیت تنظیمی دارند، بیان میشود. جهش در FoxP3 با بیماریهای خودایمنی ارثی Scurfy در موشها و همتای انسانی آن IPEX (اختلال در تنظیم ایمنی، پلی اندوکرینوپاتی و سندرم وابسته به آنتروپاتی X) مرتبط است.
FoxP3 برای تایید خلوص و بازده Tregs جدا شده یا برای مشخص کردن سلولهای Treg ثابت مفید است. با این حال، برای استفاده در جداسازی سلولهای Treg زنده مناسب نیست زیرا رنگآمیزی FoxP3 نیاز به تثبیت و نفوذپذیری سلولها دارد. در این موارد، امضای سطح CD25+CD127 راه حل بهتری است. کلون آنتی بادی مونوکلونال FoxP3 انسانی 259D/C7 با تمام ایزوفرمهای شناسایی شده فعلی فاکتور رونویسی FoxP3 انسانی واکنش میدهد و با cynomolgus، rhesus و baboon واکنش متقابل دارد.
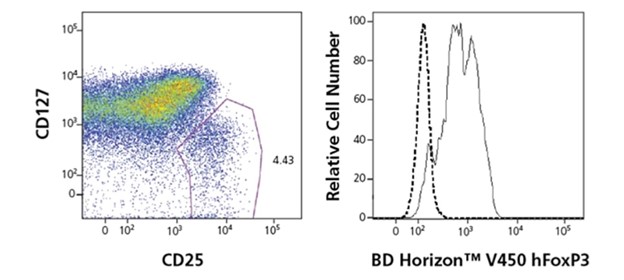
آنتی بادی Pharmingen Human FoxP3، موجود در چندین اندازه، یک معرف برای تشخیص Tregs مثبت FoxP3 است. یک سیستم بافری با کاربری آسان به محققان این امکان را میدهد که سلولها را تنها در چند مرحله ساده، با امکان انجماد نمونهها تا ۷۲ ساعت، تعمیر و نفوذپذیر کنند. در حالی که FoxP3 یک مارکر متداول برای شناسایی، جداسازی و خصوصیات Treg است، Tregs یک حوزه تحقیقاتی بسیار فعال است و فهرستی از اهداف در حال ظهور در این حوزه منتشر شده است. برای حمایت از این اکتشافات نوظهور، مجموعه معرفها و محلولهای جدید با کیفیت بالا همچنان در حال رشد هستند.
CD39: شناسایی پیشرفته Tregs
اخیراً نشان داده شده است که CD39 عمدتاً روی سلولهای B، سلولهای دندریتیک و زیرمجموعههای خاصی از سلولهای T موضعی شده بود و با FoxP3 در CD4+ Tregs در انسان و موش بیان میشود.
این کشف در حال افزودن به فهرست رو به رشد مارکرهای سطح سلولی مانند CD25، CD45RA، HLA-DR و CTLA-4 است که در شناسایی و خصوصیات عملکردی CD4+Tregs مهم هستند.
ATP خارج سلولی و متابولیتهای آن مولکولهای تنظیم کننده قوی هستند که طیف وسیعی از عملکردهای سلولی و اندام را تعدیل میکنند. انتشار ATP سلولی مارکر تخریب بافت و سیگنال خطری است که پاسخ ایمنی را فعال میکند. CD39 ATP خارج سلولی (یا سایر تری فسفاتها) را به نوکلئوتیدهای مربوطه خود مانند AMP هیدرولیز میکند. مونوفسفاتهای نوکلئوزیدی خارج سلولی به نوبه خود به سرعت توسط
ecto-5′ nucleotidases (CD73) محلول یا متصل به غشاء به نوکلئوزیدها (مانند آدنوزین) تجزیه میشوند. آدنوزین دور سلولی سپس پاسخهای ضد التهابی سلولهای T را واسطه گری میکند. تصور میشود که بیان مشترک CD39 و CD73 یکی از مکانیسمهای کلیدی سرکوب سیستم ایمنی با واسطه Tregs است.
آنتی بادی مونوکلونال ضد انسان CD39 Pharmingen (کلون TÜ66) یک مارکر برای Tregs انسانی است و به عنوان ترکیبات PE و APC در کیتهای معرف آماده برای فلوسایتومتری موجود است. TÜ66، ENTPD1 را میشناسد، یک اکتوآنزیم که متعلق به خانواده اکتونوکلئوزید تری فسفات دی فسفو هیدرولازها (E-NTPDases) است. اعضای این خانواده در کاتابولیسم نوکلئوتیدی خارج سلولی نقش دارند و مخزن تری فسفات نوکلئوزیدی خارج سلولی (NTPs) را کنترل میکنند.
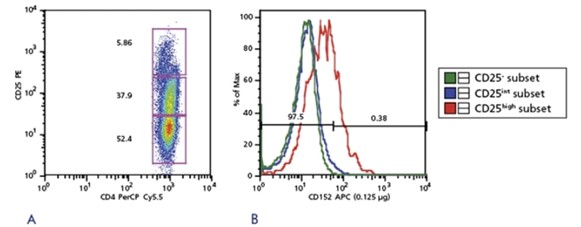
CD152: CTLA4
آنتی ژن لنفوسیت T سیتوتوکسیک 4 (CTLA-4 یا CD152) برای عملکرد سرکوب کننده Treg حیاتی است. انسداد CD152 فعالیتهای سرکوب کننده Tregs را مختل میکند. گزارش شده است که ناهنجاری در بیان CD152 در بیماریهای خودایمنی مانند آرتریت روماتوئید (rheumatoid arthritis) نقش دارد. وجود جمعیتهای مشخص، مارکرهای موجود و مارکرهای نوظهور به اکتشافات جدید هیجانانگیز در بیولوژی Treg کمک زیادی میکند.
Treg enrichment
Tregs جمعیت کوچکی از سلولها را نشان میدهد. غنی سازی (enrichment) اغلب برای تحلیل پایین دستی ضروری است. چندین روش برای غنی سازی کل یا زیرجمعیتهای Tregs وجود دارد. در حالی که FoxP3 در حال حاضر پذیرفته شده ترین مارکر برای Tregs در نظر گرفته میشود، محلیسازی درون سلولی آن استفاده از آن را برای جداسازی Tregsهای زنده ممنوع میکند. سایر مارکرهای مورد استفاده برای غنی سازی یا منفی، مثبت و یا در ترکیب استفاده میشوند. یکی از روشهای گزارش شده برای انتخاب منفی، حذف سلولهای بیان کننده CD127 و CD49d است. سلولهای بیان کننده CD4+ و بالاترین سطوح CD25 برای انتخاب مثبت (positive selection) استفاده میشوند. روشهای ترکیبی میتواند شامل استفاده از دانههای مغناطیسی برای حذف جمعیتهای آلوده قبل از مرتبسازی سلولی باشد. یکی از پرکاربردترین رویکردها، سلولهای CD4+، CD25+، CD127 را غنی میکند.

علاوه بر این، تعریف سطوح بالا و پایین بیان CD25 همخوانی ندارند که استفاده از آن را برای به دست آوردن Tregs انسانی زنده از طریق مرتبسازی سلولهای فلوسایتومتری محدود کرده است. در نتیجه، بسیاری از محققان تنها سلولهایی را انتخاب میکنند که بالاترین بیان CD25 را داشته باشند و به طور چشمگیری بازده Tregs جدا شده را کاهش میدهند. این نتایج تحقیقات را برای شناسایی مارکرهای سطح سلولی غیر از CD4 و CD25 که منحصر به Tregs انسانی هستند، تشدید کرد.
پیش غنی سازی (pre-enrichment) سلولهای CD4+T مبتنی بر مغناطیس برای افزایش عملکرد Tregs انسانی
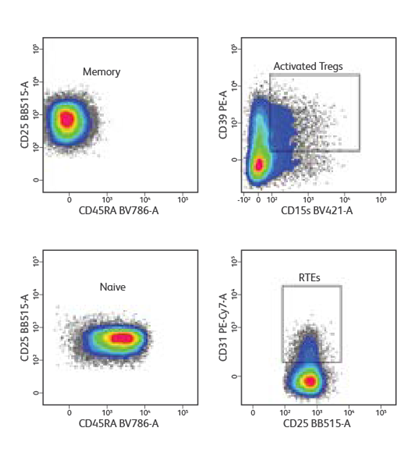
سلولهای تک هستهای خون محیطی از یک اهدا کننده سالم جدا شده و با cocktail of surface markets (CD3، CD4، CD25، CD127 و CD45RA) برای تشخیص و خالصسازی زیرمجموعههای Treg رنگ آمیزی شدند. لنفوسیتها و منفردها (singlets) ابتدا بر اساس ویژگیهای پراکندگی نور که بواسطه قرار گیری (gating) سلولهایT +CD3+CD4 (نمایش داده نشده) دنبال میشود، قرار گرفتند. Tregs به عنوان CD127low/neg CD25high شناسایی شدند. از Treg gate، +CD45RA ساده (naive) و CD45RA- memory Tregs شناسایی و در 5000 رویداد در ثانیه (events/sec) در حالت خلوص (purity mode) مرتب شدند. تجزیه و تحلیل پس از مرتب سازی، جمعیتهای همگن حافظه و Tregs ساده را نشان داد. سپس سلولهای خالص شده از نظر مارکرهای سطحی اضافی (CD31، CD39 و CD15s) برای ایمونوفنوتایپ رنگ آمیزی شدند. CD31+ recent thymic emigrants (RTEs) در CD45RA+ naive Tregs شناسایی شدند، در حالی که Tregs بسیار فعال در CD45RA- memory Tregs شناسایی شدند.